Anken: Từ điển, cấu trúc phân tử, tính chất và cách điều chế

Anken là gì? Đồng đẳng – đồng phân và danh pháp
Theo sách giáo khoa Hóa học 11, anken là những hidrocacbon mạch hở mà trong phân tử có một liên kết đôi C=C.
Dãy đồng đẳng anken
Etilen (CH2=CH2) và các chất tiếp theo có công thức anken là C3H6, C4H8, C5H10,… có tính chất tương tự etilen lập thành dãy đồng đẳng có công thức phân tử chung CnH2n (n >= 2) được gọi là anken hay oletin.
Đồng phân
Tìm hiểu đồng phân anken, chúng ta sẽ đi vào chi tiết đồng phân cấu tạo và đồng phân hình học của nó.
-
Đồng phân cấu tạo: Etilen và propilen không có đồng phân anken. Từ C4H8 trở đi ứng với một công thức phân tử có các đồng phân anken về vị trí liên kết đôi và về mạch cacbon.
-
Đồng phân hình học: Trong phân tử anken, mạch chính là mạch cacbon dài nhất có chứa liên kết đôi C=C. Những anken mà mỗi nguyên tử cacbon ở vị trí liên kết đôi liên với hai nhóm nguyên tử khác nhau sẽ có sự phân bố không gian khác nhau của mạch chính xung quanh liên kết đôi. Chính sự phân bố khác nhau đó tạo ra đồng phân về vị trí không gian của các nhóm nguyên tử gọi là đồng phân hình học.
-
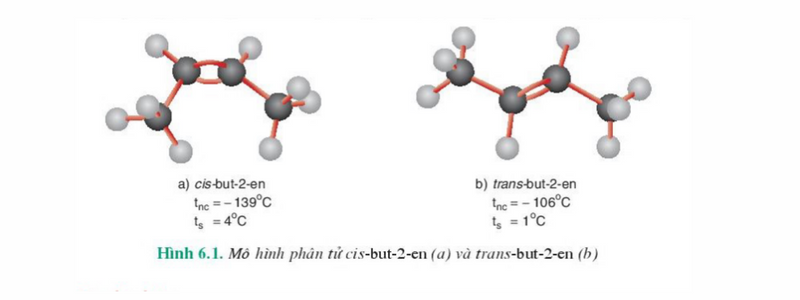
Đồng phân cis: Đồng phân có mạch chính ở cùng một phía với liên kết C=C.
-
Đồng phân trans: Đồng phân có mạch chính ở về hai phía khác nhau của liên kết C=C.
-
Ví dụ: Với công thức cấu tạo CH3-CH=CH-CH3 có các đồng phân hình học như hình dưới.
Danh pháp anken là gì?
Cách gọi tên anken bao gồm tên thông thường và tên thay thế.
-
Cách đọc tên anken thông thường: Được gọi bằng tên ankan nhưng thay đuôi “an” thành “ilen”. Ví dụ như etilen (C2H4), propilen (C3H6), butilen (C4H8).
-
Tên thay thế của anken: Xuất phát từ tên ankan tương ứng bằng cách đổi đuôi “an” thành “en”. Từ CH4 trở đi, trong tên anken cần thêm số chỉ vị trí nguyên tử cacbon đầu tiên chứa liên kết đôi. Mạch cacbon được đánh số từ phía gần liên kết đôi hơn.
Quy tắc được tổng hợp như sau:
- Chọn mạch C dài nhất và có chứa liên kết đôi làm mạch chính.
- Đánh số C mạch chính từ phía có vị trí gần liên kết đôi nhất.
- Gọi tên theo thứ tự như sau: Số chỉ vị trí nhánh + Tên nhánh + Tên C mạch chính + Số chỉ liên kết đôi + en.
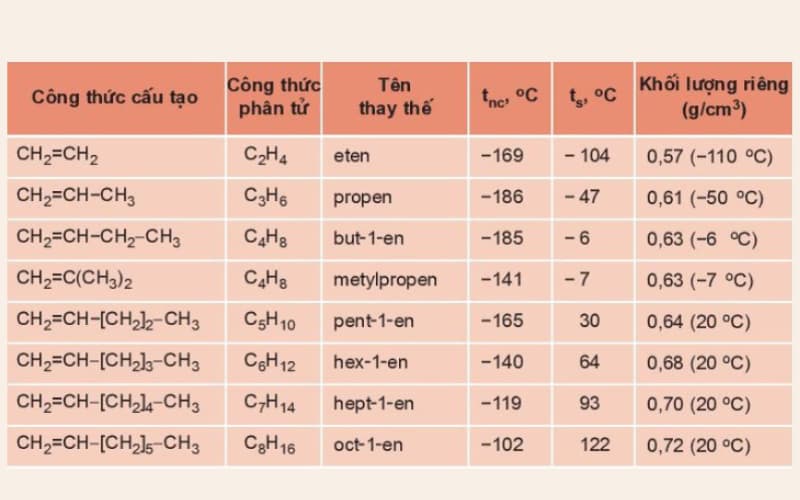
Bảng: Tên thay thế và một vài hằng số vật lý của một số anken
Tính chất vật lý của anken
Nhắc đến tính chất vật lý của anken, chúng ta không thể bỏ qua một số tính chất quan trọng sau:
- Trong điều kiện thường, các anken từ C2H4 đến C4H8 là chất khí; từ C5H10 trở đi là chất rắn hoặc lỏng.
- Nhiệt độ nóng chảy, nhiệt độ sôi, khối lượng riêng của anken tăng dần theo chiều tăng của phân tử khối.
- Tất cả các anken đều nhẹ hơn nước (D < 1g/cm3).
- Anken không tan trong nước.
Tính chất hóa học của anken
Liên kết đôi C=C gồm liên kết σ và một liên kết π (liên kết π kém bền hơn liên kết σ) do vậy dễ dàng bị phân cắt hơn, gây nên tính chất hóa học đặc trưng của anken đó là dễ dàng tham gia phản ứng cộng tạo thành hợp chất no tương ứng.
Phản ứng cộng
Phản ứng cộng anken gồm phản ứng cộng hidro, phản ứng cộng halogen và phản ứng cộng HX.
-
Phản ứng cộng hidro của anken: Khi đun nóng có kim loại niken (hoặc platin/ plaid) làm xúc tác, anken kết hợp với hidro tạo thành ankan tương ứng. Ví dụ: CH2=CH-CH3 + H2 → CH3-CH2-CH3 (Điều kiện: Ni, nhiệt độ)
-
Phản ứng cộng halogen: Thực hiện thí nghiệm dẫn etilen từ từ đi vào dung dịch brom, thấy màu nâu đỏ của dung dịch bị nhạt dần. Ta có phương trình như sau: CH2=CH2 + Br2 (nâu đỏ) → CH2Br-CH2Br (1,2-đibrometan, không màu). Tiếp tục thực hiện rót dung dịch brom vào cốc đựng anken (lỏng), quan sát thấy dung dịch brom bị mất màu. Ta có phương trình phản ứng như sau: CnH2n + Br2 → CnH2nBr2
- Phản ứng cộng HX: Các anken cũng tham gia vào phản ứng cộng với nước, hidro halogen (HBr, HCl, HI) và với các axit mạnh. Một số ví dụ minh họa: CH2=CH2 + H-OH → CH3-CH2-OH (Điều kiện H+) hoặc CH2=CH2 + H-Br → CH3-CH2-Br
Các Anken có cấu tạo phân tử không đối xứng khi tác dụng với HX có thể sinh ra hỗn hợp 2 sản phẩm. Ví dụ như: - CH3-CH=CH2 + HBr → CH3-CHBr-CH3 (2-brompropan – sản phẩm chính)
- CH3-CH=CH2 + HBr → CH3-CH2-CH2Br (1-brompropan – sản phẩm phụ)
Quy tắc cộng HX hay còn được gọi là quy tắc Markovnikov sau: - Nguyên tử H sẽ gắn với nguyên tử cacbon bậc thấp, cụ thể là C ở liên kết đôi có nhiều H hơn.
- Nhóm halide (X) sẽ gắn với nguyên tử cacbon bậc cao, cụ thể là C ở liên kết đôi có ít H hơn.
- Sản phẩm chính của phản ứng chính là sản phẩm được tạo thành theo quy tắc Markovnikov.
Phản ứng trùng hợp
Ở nhiệt độ và áp suất cao với chất xúc tác thích hợp, các phân tử anken có thể kết hợp với nhau tạo thành những mạch rất dài và có phân tử khối lớn.
Ví dụ:
… + CH2=CH2+CH2=CH2+CH2=CH2+…→… -CH2-CH2-CH2-CH2-CH2-CH2-… (Polietylen hay PE)
Phản ứng trùng hợp thuộc loại phản ứng polimer hóa, là quá trình liên kết nhiều phân tử nhỏ giống nhau hoặc tương tự nhau để tạo thành những phân tử rất lớn, gọi là polime. Trong đó:
- Chất đầu (CH2 = CH2) là monome.
- -CH2 – CH2- là mắc xích của polime.
- n là hệ số trùng hợp.
Phản ứng oxi hóa
Phản ứng oxi hóa hoàn toàn và phản ứng oxi hóa không hoàn toàn cũng là một trong những tính chất hóa học quan trọng của anken.
Phản ứng oxi hóa hoàn toàn
Khi bị đốt với oxi, etilen và các đồng đẳng sẽ bị cháy và tỏa ra nhiệt.
CnH2n + 3n/2 O2 → nCO2 + nH2O
Phản ứng oxi hóa không hoàn toàn của anken
Để làm rõ phản ứng oxi hóa không hoàn toàn của anken, ta thực hiện thí nghiệm sục khí etilen từ từ đi vào dung dịch KMnO4. Quan sát thấy màu của dung dịch sẽ nhạt dần và có kết tủa màu nâu đen của MnO2.
Ta có phản ứng như sau:
3CH2=CH2 + 4H2O + 2KMnO4 → 3HO-CH2-CH2-OH + 2MNO4 (kết tủa) + 2KOH
Hy vọng với những thông tin này, bạn đã hiểu rõ hơn về khái niệm, tính chất và cách điều chế anken. Hãy tiếp tục theo dõi wsc.edu.vn để cập nhật thêm nhiều kiến thức hấp dẫn khác nhé!