Oxi: Khám phá tính chất, ứng dụng và cách điều chế
![Oxi: Tính chất, ứng dụng và cách điều chế [Tổng hợp Lớp 8 + 10]](https://wsc.edu.vn/wp-content/uploads/2024/04/cong-thuc-phan-tu-cua-oxi-780x470.jpg)
Oxi là gì?
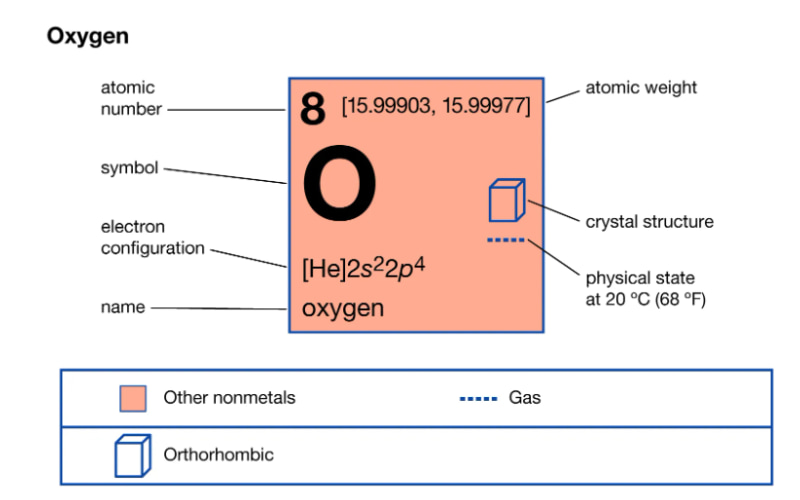
Oxi, còn được gọi là Oxygen trong tiếng Anh, là một nguyên tố hóa học được ký hiệu là O. Đơn chất oxi (trạng thái khí) có công thức hóa học là O2; nguyên tử khối là 16 và phân tử khối là 32. Oxi là một nguyên tố hóa học phổ biến và chiếm khối lượng lớn nhất trong vỏ Trái Đất. Ngoài dạng khí, oxi cũng có trong đường, nước, quặng, đất đá, cơ thể người và động vật…
Nguyên tử oxi có số hiệu là 8, thuộc nhóm VIA và chu kì 2 trong bảng tuần hoàn các nguyên tố hóa học. Cấu hình electron của nguyên tử oxi là 1s22s22p4, với lớp ngoài cùng có 6e. Trong điều kiện bình thường, phân tử oxi có 2 nguyên tử liên kết với nhau bằng liên kết cộng hóa trị không cực, có thể viết công thức cấu tạo phân tử oxi là O=O.
Tính chất vật lý của oxi
Để hiểu rõ hơn về tính chất vật lý của khí oxi, SGK Hóa học lớp 8 (NXB Giáo dục Việt Nam) đã đưa ra một tình huống quan sát cùng với những câu hỏi gợi mở để các bạn có thể hình dung rõ ràng hơn.
Khí oxi là chất khí không màu, không mùi, không vị và nặng hơn không khí. Vậy, ta có thể quan sát và nhận xét màu sắc cũng như mùi của khí oxi.
2 câu hỏi tiếp theo được đưa ra để tìm hiểu tính chất của oxi là:
- 1 lít nước ở 20 độ C hòa tan được 31 ml khí oxi. Có chất khí (ví dụ amoniac) tan được 700 lít trong 1 lít nước. Vậy khí oxi là chất tan nhiều hay ít trong nước?
- Xác định khí oxi nặng hay nhẹ hơn không khí? (Cho biết tỉ khối của oxi đối với không khí là 32:29).
Sau khi trả lời được những câu hỏi và quan sát trên, ta có thể kết luận những tính chất vật lý điển hình của khí oxi như sau:
- Khí oxi là chất khí không màu, không mùi, không vị và nặng hơn không khí (độ tương đối là 32/29, xấp xỉ bằng 1.1).
- Dưới áp suất khí quyển, oxi hóa lỏng ở nhiệt độ -183 độ C.
- Khí oxi ít tan trong nước, 100ml nước ở 20 độ C, 1 atm hòa tan được 3.1ml khí oxi.
- Độ tan của khí oxi ở 20 độ C và 1 atm là 0.0043g trong 100g H2O.
Tính chất hóa học của oxi
Không thể không nói về những tính chất hóa học cơ bản của oxi. Oxi là một đơn chất phi kim rất hoạt động, đặc biệt ở nhiệt độ cao, dễ tham gia phản ứng hóa học với nhiều kim loại, phi kim và hợp chất. Trong các hợp chất hóa học, nguyên tố Oxi có hóa trị II.
Oxi tác dụng với kim loại
SGK Hóa học lớp 8 đã đưa ra một ví dụ thí nghiệm để chứng minh oxi có thể tác dụng với kim loại:
Lấy một đoạn dây sắt nhỏ đưa vào lọ đựng khí oxi. Quan sát thí nghiệm để xem có phản ứng hóa học nào xảy ra không. Tiếp tục quấn thêm một mẩu than gỗ vào đầu dây sắt, đốt cho sắt và than nóng đỏ rồi đưa vào lọ chứa khí oxi. Qua quan sát chúng ta có thể nhận thấy: Khi cho dây sắt có quấn mẩu than gỗ vào lọ khí oxi, mẩu than cháy trước tạo nhiệt độ đủ cao cho sắt cháy. Sắt cháy mạnh, sáng chói không có ngọn lửa, không có khói, tạo ra các hạt nhỏ nóng chảy màu nâu là sắt (II, III) oxit, có công thức hóa học là Fe3O4 (oxit sắt từ).
Phương trình hóa học xảy ra như sau:
3Fe (r) + 2O2 (k) → Fe3O4 (Điều kiện: Nhiệt độ)
Ví dụ khác: Mg + O2 → 2MgO (Điều kiện: Nhiệt độ)
Oxi tác dụng với phi kim
-
Oxi tác dụng với lưu huỳnh (S): Thực hiện thí nghiệm đưa muỗn sắt chứa một lượng nhỏ bột lưu huỳnh vào ngọn lửa đèn cồn để quan sát. Tiếp tục đưa lưu huỳnh đang cháy vào lọ có chứa khí oxi và so sánh hiện tượng lưu huỳnh cháy trong oxi và trong không khí. Qua quan sát, ta có thể nhận thấy: Lưu huỳnh cháy trong không khí với ngọn lửa nhỏ màu xanh nhạt, khi cháy trong không khí mãnh liệt hơn tạo thành khí lưu huỳnh đioxit SO2 (hay khí sunfurơ) và rất ít lưu huỳnh trioxit (SO3). Sự cháy của lưu huỳnh trong không khí và trong oxi được biểu diễn bằng phương trình hóa học.
-
Oxi tác dụng với photpho (P): Thực hiện thí nghiệm cho vào muỗng sắt một lượng photpho đỏ (chất rắn có màu đỏ nâu, không tan trong nước). Đưa muỗng sắt có chứa photpho vào lọ đựng khí oxi. Quan sát sự cháy của photpho trong không khí và trong khí oxi. Nhận xét chất tạo thành ở trong lọ và thành lọ. Qua quá trình quan sát, ta có thể dễ dàng nhận thấy: Photpho cháy mạnh trong khí oxi với ngọn lửa sáng chói, tạo ra khói trắng dày đặc bám vào thành lọ dưới dạng bột tan được trong nước. Bột trắng đó là điphotpho pentaoxit, với công thức hóa học là P2O5.
Oxi tác dụng với hợp chất
Ngoài tác dụng với kim loại và phi kim, oxi còn tác dụng với hợp chất, đây cũng là một trong những tính chất hóa học quan trọng của oxi.
-
Oxi tác dụng với khí metan (CH4): Khí metan cháy trong không khí do tác dụng với khí oxi sẽ tỏa ra nhiệt. Phương trình hóa học biểu diễn sự cháy của butan như sau:
CH4 (k) + 2O2 (k) → CO2 (k) + 2H2O (h) (Điều kiện: Nhiệt độ)
-
Oxi tác dụng với CO (CO cháy trong không khí): Phương trình hóa học như sau: 2CO + O2 → 2CO2
-
Oxi tác dụng với etanol (C2H5OH): Phương trình hóa học như sau: C2H5OH + 3O2 → 2CO2 + 3H2O
Cách điều chế oxi
Có nhiều cách để điều chế oxi, tùy thuộc vào mục đích sử dụng. Dưới đây là những cách điều chế và sản xuất oxi trong phòng thí nghiệm và trong công nghiệp phổ biến nhất!
Điều chế oxi trong phòng thí nghiệm
Trong phòng thí nghiệm, khí oxi được điều chế bằng cách phân hủy những hợp chất giàu oxi và ít bền đối với nhiệt như KMnO4 (dạng rắn), KClO3 (dạng rắn)…
Phương trình hóa học như sau:
2KMnO4 → K2MnO4 + MnO2 + O2 (Điều kiện: Nhiệt độ)
Sản xuất oxi trong công nghiệp
Có 2 cách để sản xuất oxi trong công nghiệp: từ không khí và từ nước.
-
Sản xuất oxi từ không khí: Sau khi đã loại bỏ hết nước, bụi, khí cacbon đioxit, không khí được hóa lỏng. Chưng cất phân đoạn không khí lỏng sẽ thu được oxi. Oxi được vận chuyển trong những bình thép có dung tích 100 lít dưới áp suất 150 atm.
-
Sản xuất oxi từ nước: Tiến hành điện phân nước (nước có hòa tan một lượng nhỏ H2SO4 hoặc NaOH để tăng tính dẫn điện của nước), ta thu được khí oxi ở cực dương và khí hidro ở cực âm. Phương trình hóa học như sau:
2H2O → (điện phân) 2H2 + O2 (k)
Ứng dụng của oxi trong đời sống
Khí oxi đóng vai trò quan trọng trong đời sống con người và trong công nghiệp đốt nhiên liệu.
-
Vai trò của oxi với sự sống của con người và động vật: Oxi có nhiều ứng dụng quan trọng và đóng vai trò quyết định sự sống của con người và động vật. Mỗi ngày, chúng ta cần khoảng 20-30m3 khí oxi để duy trì sự sống. Những nghề nghiệp như thợ chữa cháy, phi công hay thợ lặn đều phải hít thở khí oxi chứa trong các bình đặc biệt.
-
Ứng dụng oxi trong công nghiệp – đốt nhiên liệu: Khi các nhiên liệu cháy trong oxi, nhiệt độ sẽ cao hơn rất nhiều so với cháy trong không khí. Oxi được ứng dụng trong các hoạt động chế tạo mìn phá đá, oxi lỏng được sử dụng để đốt nhiên liệu trong tên lửa. Một ứng dụng khá quen thuộc của oxi trong công nghiệp là thổi khí oxi để tạo nhiệt độ cao hơn, nâng cao hiệu suất và chất lượng của gang và thép.
Kết luận
Oxi là một nguyên tố hóa học quan trọng và có nhiều tính chất vật lý và hóa học đặc biệt. Những đặc điểm này đã tạo nên ứng dụng quan trọng của oxi trong đời sống con người và công nghiệp. Hi vọng thông tin này đã giúp bạn hiểu rõ hơn về oxi và những ứng dụng của nó.
Đọc thêm tại wsc.edu.vn để tìm hiểu thêm kiến thức về các nguyên tố khác nhé!
Còn đâu: Iot là gì? Tính chất và những ứng dụng phổ biến nhất
Điều chế Oxi: Có nhiều cách để điều chế Oxi. Trong phòng thí nghiệm, khí Oxi có thể được điều chế bằng cách phân hủy những hợp chất giàu Oxi và ít bền đối với nhiệt như KMnO4 (dạng rắn), KClO3 (dạng rắn)… Trong công nghiệp, Oxi được sản xuất từ không khí hoặc từ nước. Điều chế Oxi từ không khí được thực hiện bằng cách loại bỏ nước, bụi, khí CO2 và sau đó hóa lỏng không khí. Sản xuất Oxi từ nước được tiến hành bằng cách điện phân nước.
Ứng dụng của Oxi: Khí Oxi có vai trò quan trọng trong đời sống con người và công nghiệp đốt nhiên liệu. Oxi đóng vai trò quyết định sự sống của con người và động vật, và được sử dụng trong nhiều lĩnh vực như y tế, hóa chất, luyện kim, công nghiệp…
Bài tập về Oxi: Nếu bạn muốn ôn tập và kiểm tra kiến thức của mình về Oxi, wsc.edu.vn cung cấp một số bài tập về Oxi từ sách giáo trình Hóa học lớp 8 và 10, kèm theo lời giải chi tiết để bạn tham khảo.