Axit Nitric (HNO3): Đặc điểm, Tính chất và Ứng dụng

Axit nitric là gì?
Khái niệm: Axit nitric là một hợp chất vô cơ có công thức hóa học HNO3, được xem là một dung dịch nitrat hidro hay còn gọi là axit nitric khan. Axit nitric được hình thành trong tự nhiên, do sấm và sét trong những cơn mưa tạo thành.
Công thức phân tử: HNO3
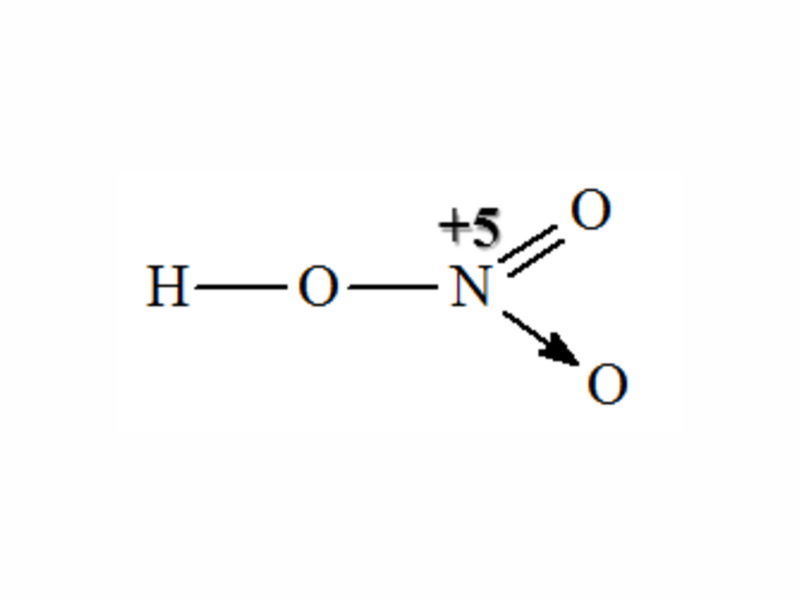
Cấu tạo phân tử:
- Mũi tên trong công thức cấu tạo Axit nitric bên trên cho biết: Cặp electron liên kết chỉ do nguyên tử nitơ cung cấp.
- Trong hợp chất HNO3, nitơ có số oxi hóa cao nhất là +5, hóa trị IV.
Tính chất vật lý của axit nitric (HNO3)
Sau đây là những tính chất vật lý cơ bản của axit nitric (HNO3) mà bạn cần nhớ:
-
Dạng tồn tại: Axit nitric tinh khiết (tỷ trọng khoảng từ 1522 kg/m3) là chất lỏng không màu, bốc khói mạnh trong không khí ẩm. Dung dịch có hơn 86% axit nitric được gọi là axit nitric bốc khói. Chúng có thể bốc khói trắng và khói đỏ tùy thuộc vào nồng độ của nitơ đioxit. Axit nitric cũng có thể tồn tại ở dạng khí, không màu. Trong môi trường tự nhiên, do sự tích tụ của nitơ nên axit nitric có màu vàng nhạt.
-
Axit cực độc: Axit nitric là một chất axit độc có khả năng ăn mòn và dễ gây cháy. D= 1.53G/cm3
-
Kém bền: Axit nitric HNO3 kém bền ngay cả ở điều kiện thường. Dung dịch HNO3 đặc phân hủy một phần giải phóng nitơ dioxit NO2 – khí này tan trong dung dịch axit, khiến dung dịch chuyển vàng.
4HNO3 → 4NO2 + 2H2O + O2 (ánh sáng mặt trời)
Đây là lý do cần bảo quản axit nitric trong các chai, lọ tối màu, tránh ánh sáng và đảm bảo nhiệt độ dưới 0°C.
-
Tan trong nước: Axit nitric tan trong nước theo bất kỳ tỉ lệ nào. (C<65%)
-
Nhiệt độ đông đặc: -42°C
-
Nhiệt độ sôi: 83°C.
Tính chất hóa học của axit nitric
Axit nitric (HNO3) là một trong những axit cực mạnh được nhắc tới nhiều nhất trong lĩnh vực hóa học và ứng dụng thực tế. Chắc hẳn bạn vô cùng tò mò về tính chất hóa học của loại axit này? Dưới đây là 3 tính chất hóa học nổi bật nhất của HNO3.
Axit nitric là một trong những axit mạnh nhất
-
Đây là một axit khan – một monoaxit mạnh có thể nitrat hóa nhiều hợp chất vô cơ với hằng số cân bằng axit (pKa) = -2.
-
Axit nitric phân li hoàn toàn thành các ion H+ và NO3- trong dung dịch loãng.
-
Dung dịch HNO3 làm quỳ tím chuyển đỏ.
-
Tác dụng với oxit bazơ, bazơ và muối của axit yếu hơn tạo ra muối nitrat.
Ví dụ:
CuO + 2HNO3 → Cu(NO3)2 + H2O
CaCO3 + 2HNO3 → Ca(NO3)2 + H2O + CO2
-
Axit nitric tác dụng với oxit bazơ, bazo, muối mà kim loại trong hợp chất này chưa lên hóa trị cao nhất:
Ví dụ:
FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
FeCO3 + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O + CO2
Axit nitric có tính oxi hóa
-
Axit nitric cũng là 1 trong những axit có tính oxi hóa mạnh. Nó có thể bị khử đến các sản phẩm khác nhau của nitơ, phụ thuộc vào nồng độ axit mạnh hay yếu của chất khử. Cùng tìm hiểu tính oxi hóa của axit nitric thông qua 3 phản ứng:
-
Tác dụng với kim loại
-
Tác dụng với phi kim
-
Tác dụng với hợp chất
Cách điều chế axit nitric HNO3
Trong tự nhiên, axit nitric (HNO3) hình thành từ những cơn mưa lớn có sét, tạo ra những trận mưa axit. Vậy trong công nghiệp và phòng thí nghiệm, đâu là cách điều chế axit nitric?
Điều chế axit nitric trong phòng thí nghiệm
Axit nitric trong phòng thí nghiệm được điều chế bằng cách đun hỗn hợp natri nitrat hoặc kali nitrat rắn với axit sunfuric (H2SO4) đặc cho đến khi còn lại chất kết tinh màu trắng.
Phương trình: NaNO3 (tinh thể) + H2SO4 (đặc) → HNO3 + NaHSO4 (nhiệt độ)
HNO3 thoát ra được dẫn vào bình, làm lạnh và ngưng tụ. Một lưu ý khi thực hiện thí nghiệm: Các dụng cụ phải có chất liệu thủy tinh do axit nitric khan.
Ngoài ra, axit nitric cũng có thể được điều chế trong phòng thí nghiệm bằng cách phân hủy nhiệt của đồng (II) nitrat tạo ra khí nitơ dioxide và khí oxy, sau đó truyền qua nước để tạo ra axit nitric.
Phương trình như sau:
2Cu(NO3)2 → 2 CuO + 4 NO2 + O2
4 NO2 + O2 → HNO2 + HNO3
3 giai đoạn sản xuất axit nitric trong công nghiệp
Để điều chế axit nitric trong công nghiệp, người ta sử dụng amoniac với 3 giai đoạn:
Giai đoạn 1:
Oxi hóa khí amoniac thành nitơ monooxit bằng oxi ở nhiệt độ 850-900 độ C với chất xúc tác là platin.
4NH3 + 5O2 → 4NO + 6H2O (850-900*C + Pt) (H<0)Giai đoạn 2:
Oxi hóa nitơ monooxit thành nitơ dioxit bằng oxi không khí trong điều kiện thường.
2NO + O2 → 2NO2Giai đoạn 3:
Cho nitơ đioxit tác dụng với nước và oxi, tạo ra axit nitric.
4NO2 + O2 + H2O -> 4HNO3Dung dịch axit nitric thu được có nồng độ từ 52 – 68%. Người ta tiếp tục chưng cất dung dịch này cùng H2SO4 đậm đặc để thu được HNO3 với nồng độ cao hơn 68%. Axit nitric công nghiệp thường có nồng độ 52% và 68%, được thực hiện bằng công nghệ Ostwald do Wilhelm Ostwald sáng chế.


.jpg)
.jpg)




