Củng cố kiến thức
Đây là một bài viết để củng cố kiến thức về anken – một khái niệm hóa học quan trọng. Anken là một nhóm các hợp chất hữu cơ có các liên kết đôi giữa các nguyên tử cacbon trong phân tử. Trong bài viết này, chúng ta sẽ tìm hiểu về đồng đẳng, đồng phân và danh pháp của anken, cùng những tính chất vật lí và hóa học đặc biệt của chúng.
Đồng đẳng, đồng phân, danh pháp
Dãy đồng đẳng anken
Etilen (CH2 = CH2) và các chất tiếp theo có công thức phân tử C3H6, C4H8, C5H10,… tạo thành dãy đồng đẳng có công thức phân tử chung CnH2n (n > 2) được gọi là anken hay olefin. Các chất trong dãy đồng đẳng này có tính chất tương tự nhau.
Đồng phân
Anken có thể tồn tại dưới dạng các đồng phân khác nhau. Có hai loại đồng phân chính:
Đồng phân cấu tạo
Etilen và propilen không có đồng phân anken. Nhưng từ C4H8 trở đi, các công thức phân tử khác nhau có thể tạo ra đồng phân anken với vị trí liên kết đôi và mạch cacbon khác nhau.
Đồng phân hình học
Trong phân tử anken, mạch chính là mạch cacbon dài nhất chứa liên kết đôi C=C. Sự phân bố không gian khác nhau của mạch chính xung quanh liên kết đôi tạo ra đồng phân hình học. Đồng phân có mạch chính ở cùng một phía của liên kết đôi được gọi là đồng phân cis-, đồng phân có mạch chính ở hai phía khác nhau của liên kết đôi được gọi là đồng phân trans-.
Danh pháp
Anken có thể được đặt tên thông thường hoặc tên thay thế. Một số anken có tên thông thường bắt nguồn từ tên ankan tương ứng bằng cách thay đổi đuôi “-an” thành “-ilen”. Ví dụ: etilen C2H4; propilen C3H6; butilen C4H8. Trường hợp từ C4H8 trở đi, trong tên anken cần chỉ rõ vị trí của nguyên tử cacbon đầu tiên chứa liên kết đôi.
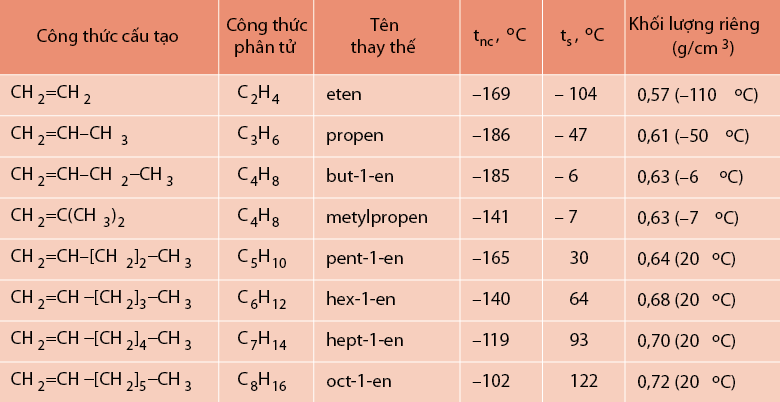
Tính chất vật lí
Các anken có các tính chất vật lí khác nhau. Các hằng số vật lí như nhiệt độ nóng chảy, nhiệt độ sôi và khối lượng riêng tăng dần theo chiều tăng của phân tử khối. Các anken từ C2H4 đến C4H8 thường là chất khí, trong khi từ C5H10 trở đi thường là chất lỏng hoặc chất rắn. Các anken đều nhẹ hơn nước và không tan trong nước.
Tính chất hóa học
Anken dễ dàng tham gia vào các phản ứng cộng, tạo thành các hợp chất no tương ứng. Các phản ứng cộng cơ bản bao gồm cộng hiđro, cộng halogen và cộng các phân tử khác như nước và axit mạnh. Anken cũng có thể tham gia vào phản ứng trùng hợp, tạo thành các polime có mạch dài và phân tử khối lớn. Ngoài ra, anken cũng có thể trải qua các phản ứng oxi hóa.
Điều chế và ứng dụng
Etilen, propilen và các anken khác là nguyên liệu quan trọng trong các quy trình sản xuất hóa học. Chúng được sử dụng để tổng hợp các polime và có nhiều ứng dụng trong cuộc sống hàng ngày.
Qua bài viết này, chúng ta đã củng cố kiến thức về anken – một khái niệm quan trọng trong hóa học. Để tìm hiểu thêm về các khái niệm về hóa học và các lĩnh vực liên quan, hãy truy cập wsc.edu.vn.




