Natri – Kim loại kiềm phổ biến nhất!
Khi học hóa, chắc hẳn các em đã gặp phải Natri trong các bài tập và phản ứng hóa học. Nhưng Natri là gì? Na hóa trị mấy? Natri có những tính chất hóa học như thế nào? Cách điều chế và ứng dụng của Na ra sao? Cùng tìm hiểu và bỏ túi kiến thức hóa học bổ ích với bài viết này nhé!
Na là gì?
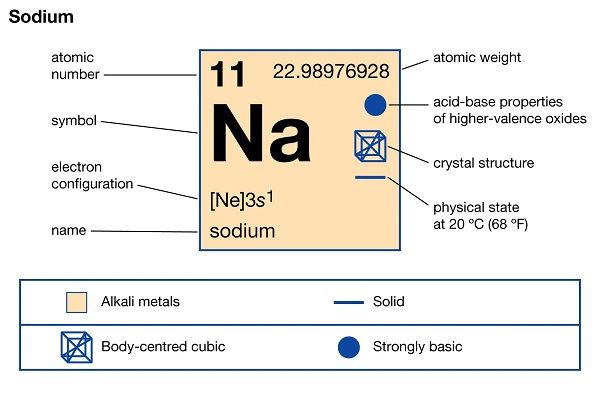
Natri (Na) là một nguyên tố hóa học nằm trong bảng tuần hoàn với số nguyên tử là 11. Natri là một kim loại mềm, có màu trắng bạc, tính kim loại, và có khả năng dẫn điện tốt. Tên tiếng Anh của Natri là Sodium.
Natri là một kim loại kiềm thổ, có khả năng tạo thành ion dương Na+ trong các phản ứng hóa học. Natri là một nguyên tố phổ biến trong tự nhiên, được tìm thấy trong nước biển, các khoáng chất, và đất đai. Natri cũng là thành phần quan trọng trong muối bình thường và nhiều muối khác được sử dụng trong công nghiệp và nấu ăn.
Natri có nhiều ứng dụng trong cuộc sống hàng ngày. Nó được sử dụng trong sản xuất soda, xà phòng, thuốc nổ, và nhiều hợp chất khác. Natri cũng là thành phần quan trọng trong điện giải, điện phân, và các ứng dụng điện hóa khác.
Na hóa trị mấy? Nguyên tử khối của Na là bao nhiêu?
Nguyên tử khối của Natri là 22,99 (~23). Với số hiệu nguyên tử là 11, cấu hình electron của Na là [Ne] 3s1. Với một electron ở lớp ngoài cùng, Natri dễ mất điện tử để tạo thành ion dương. Vì vậy, Natri có hóa trị là 1+.
Lịch sử của nguyên tố Natri (Na)
Natri đã được biết đến từ thời cổ đại. Người Ai Cập cổ đại và người Hy Lạp đã nhận ra sự tồn tại của muối Natri trong nước biển và đá muối.
Natri được xem là một nguyên tố hóa học riêng biệt và là một nguyên tố kim loại kiềm. Trong thế kỷ 19, các nhà khoa học như Humphry Davy đã nghiên cứu và khám phá tính chất của Natri, đóng góp quan trọng cho sự hiểu biết hiện tại về nguyên tố này.
Trở thành một thành phần quan trọng trong công nghiệp hóa chất, Natri có thể tạo ra nhiều hợp chất khác nhau như Natri hidroxit, Natri cacbonat và nhiều hợp chất khác. Natri được sử dụng trong sản xuất xà phòng, chất tẩy rửa, thuốc nhuộm, giấy, thủy tinh và nhiều ngành công nghiệp khác.
Tính chất vật lý của Natri (Na)
- Trạng thái vật lý: Natri là một kim loại ở nhiệt độ và áp suất thông thường. Nó tồn tại dưới dạng chất rắn ở nhiệt độ phòng.
- Kiểu mạng tinh thể: Lập phương tâm khối.
- Màu sắc và bề ngoài: Natri có màu trắng bạc và bề ngoài nhẵn bóng.
- Điểm nóng chảy: Khoảng 97,72 °C (207,90 °F). Điểm nóng chảy thấp này cho phép Natri dễ dàng tan chảy và sử dụng trong các ứng dụng hóa học và công nghiệp.
- Điểm sôi: Khoảng 883 °C (1621 °F). Khi đun nóng đến điểm sôi, Natri chuyển từ trạng thái rắn sang trạng thái hơi.
- Khối lượng riêng: Khoảng 0,97 g/cm3. Natri có mật độ thấp hơn nhiều so với nước.
- Dẫn điện: Natri là một chất dẫn điện tốt, được sử dụng trong các ứng dụng điện hóa như pin và điện phân.
- Dẫn nhiệt: Natri có khả năng dẫn nhiệt tốt, được sử dụng trong các ứng dụng truyền nhiệt và làm mát.
- Nhiệt biết: Khi đốt cháy, Natri tạo ra ngọn lửa có màu vàng.
Các tính chất hóa học của Na
Natri là một nguyên tố hóa học có tính khử mạnh. Nó có thể phản ứng với các phi kim, axit, nước và hidro.
Na tác dụng với phi kim
Khi đốt cháy Natri trong không khí hoặc oxi, nó tạo ra các oxit thường, peoxit và supeoxit. Phản ứng này tạo ra ngọn lửa có màu vàng đặc trưng.
4Na + O2 → 2Na2O
2Na + Cl2 → 2NaCl
Na tác dụng với axit
Natri có khả năng khử ion H+ trong các dung dịch axit loãng như HCl hoặc H2SO4 loãng. Phản ứng này tạo ra muối mới và giải phóng khí hidro.
2Na + 2HCl → 2NaCl + H2
2Na + H2SO4 → Na2SO4 + H2
Lưu ý: Cần cẩn thận khi làm thí nghiệm hoặc nghiên cứu với Natri, vì nó có khả năng nổ khi tiếp xúc trực tiếp với axit.
Na tác dụng với nước
Natri có tính háo nước và tác dụng mãnh liệt khi tiếp xúc với nước. Quá trình phản ứng tạo ra dung dịch kiềm và giải phóng khí hidro. Thường sử dụng dầu hỏa để bảo quản các kim loại kiềm như Natri.
2Na + 2H2O → 2NaOH + H2
Na tác dụng với hidro
Ở điều kiện áp suất cao và nhiệt độ cao từ 350 – 400 °C, Natri phản ứng với khí hidro để tạo thành Natri hidrua.
2Na (lỏng) + H2 (khí) → 2NaH (rắn)
Cách điều chế Na hiện nay
Natri có thể được điều chế bằng phương pháp điện phân muối Natri trong điện giải hoặc bằng cách tái chế từ các hợp chất chứa Natri khác.
Điện phân muối Natri:
- Muối Natri (thường là muối clorua Natri, NaCl) được chứa trong một dung dịch Natri clorua nóng chảy.
- Dung dịch Natri clorua được đổ vào một điện giải có hai điện cực: một điện cực âm (cathode) và một điện cực dương (anode).
- Khi áp dụng điện áp vào điện giải, ion Na+ trong dung dịch di chuyển đến cathode và nhận electron, tạo thành Natri kim loại.
- Natri kim loại được thu thập ở cathode và được chế phẩm thành các đơn vị Natri.
Na+ + e → Na
2Cl- – 2e → Cl2
2NaCl (n/c) → 2Na + Cl2↑
Tái chế Natri từ muối Natri khác:
- Natri có thể được tái chế từ các hợp chất chứa Natri như Natri hidroxit (NaOH) hoặc Natri cacbonat (Na2CO3).
- Hợp chất chứa Natri được đun nóng để phân hủy thành Natri và các sản phẩm khí hoặc chất rắn khác.
- Natri kim loại được thu thập và tinh lọc để loại bỏ các tạp chất có thể có.
Cả hai phương pháp trên đều yêu cầu các biện pháp an toàn thích hợp vì liên quan đến điện phân và xử lý chất cháy nổ. Lưu ý rằng điều chế Natri nên được thực hiện bởi những người có kinh nghiệm và trong một môi trường thích hợp như phòng thí nghiệm hoặc nhà máy sản xuất.
Trạng thái tự nhiên của Natri (Na)
Trong tự nhiên, Natri (Na) có 13 đồng vị với khối lượng nguyên tử từ 18 đến 30. Tuy nhiên, chỉ có một đồng vị ổn định là 23Na, chiếm khoảng 100% tỷ lệ tự nhiên của Natri.
Natri là một nguyên tố phổ biến trong vỏ Trái Đất, chiếm khoảng 2,6% khối lượng của vỏ Trái Đất. Natri được tìm thấy chủ yếu dưới dạng muối, như muối clorua Natri (NaCl), trong đá muối và nước biển. Các mỏ muối trên toàn thế giới cũng là nguồn cung cấp quan trọng của Natri.
Một số hợp chất quan trọng của Na
Một số hợp chất quan trọng của Natri bao gồm:
- Muối Natri Clorua (NaCl): Sử dụng rộng rãi trong công nghiệp thực phẩm, làm gia vị và bảo quản thực phẩm. Natri clorua cũng được sử dụng trong công nghiệp hóa chất, xử lý nước và nhiều ứng dụng khác.
- Natri hidroxit (NaOH): Còn được gọi là kiềm Natri, sử dụng trong công nghiệp hóa chất, sản xuất xà phòng, làm sạch và xử lý nước.
- Natri cacbonat (Na2CO3): Còn được gọi là soda ash hoặc muối xà phòng, được sử dụng trong công nghiệp thuốc nhuộm, sản xuất thủy tinh, chất tẩy rửa và sản xuất giấy.
- Natri hidrocacbonat (NaHCO3): Còn được gọi là baking soda, sử dụng trong nấu ăn, nướng bánh, chăm sóc cá nhân và làm đẹp.
- Natri Nitrat (NaNO3): Hợp chất quan trọng trong phân bón và chất bảo quản thực phẩm.
- Natri Silicat (Na2SiO3): Sử dụng trong sản xuất chất tẩy rửa, chất đông đặc và công nghiệp thủy tinh.
Ứng dụng của Natri (Na)
Natri có ứng dụng trong nhiều lĩnh vực công nghiệp và đời sống:
- Công nghiệp hóa chất: Sử dụng làm chất khử trong nhiều quá trình công nghiệp, sản xuất xà phòng, chất tẩy rửa, thuốc nhuộm, giấy và thủy tinh.
- Xử lý nước: Sử dụng hydroxit Natri (NaOH) để xử lý nước, tăng độ kiềm và cân bằng pH, tẩy trắng và khử kim loại nặng.
- Năng lượng: Sử dụng trong các pin ion-liti hiệu suất cao và có thể tái sử dụng, hệ thống lưu trữ năng lượng.
- Nấu ăn: Muối clorua Natri (muối bình thường) là thành phần quan trọng của thực phẩm và gia vị, cung cấp hương vị mặn và cân bằng vị gia vị trong các món ăn.
- Y học: Cần thiết cho hoạt động thần kinh, cơ bắp và quá trình sinh tổng hợp.
- Sản xuất giấy: Sử dụng carbonat Natri (soda ash) để điều chỉnh độ kiềm của nước và điều chỉnh pH trong quá trình sản xuất giấy.
- Công nghiệp thủy tinh: Sử dụng silicat Natri để sản xuất sản phẩm thủy tinh và chất tạo màu.
- Công nghiệp nhiệt điện: Sử dụng để tạo hơi nước và sinh năng lượng điện.
- Các ứng dụng khác: Sử dụng trong sản xuất chất tẩy rửa, chất đông đặc, chất tẩy trắng và điều chỉnh pH trong quá trình công nghiệp.
Natri là một nguyên tố có ứng dụng rất rộng trong nhiều lĩnh vực của cuộc sống. Hy vọng bài viết này đã giúp các em hiểu rõ hơn về Natri và các tính chất của nó. Chúc các em đạt kết quả cao trong môn hóa học và tiếp tục khám phá thêm nhiều nguyên tố khác trên wsc.edu.vn.












